Derechos de autor reservados - Prohibida su reproducción
CIRCULAR EXTERNA 10 DE 2020
(mayo 20)
Diario Oficial No. 51.321 de 21 de mayo de 2020
SUPERINTENDENCIA NACIONAL DE SALUD
<NOTA DE VIGENCIA: Circular derogada por la Circular 18 de 2020>
| PARA: | DIRECCIONES DEPARTAMENTALES Y DISTRITALES, ENTIDADES PROMOTORAS DE SALUD (EPS), ENTIDADES ADAPTADAS, REGÍMENES ESPECIAL y DE EXCEPCIÓN Y ADMINISTRADORAS DE RIESGOS LABORALES (ARL). |
| DE: | SUPERINTENDENCIA NACIONAL DE SALUD. |
| ASUNTO: | INSTRUCCIONES Y REQUERIMIENTOS DE INFORMACIÓN FRENTE AL DIAGNÓSTICO EN EL MARCO DE LA PANDEMIA COVID-19. |
| FECHA: | 20 DE MAYO DE 2020 |
I. ANTECEDENTES
Desde enero del presente año, cuando se notificó el brote de neumonía grave en Wuhan, provincia de Hubei, en China, el cual fue posteriormente denominado por la Organización Mundial de la Salud como enfermedad por coronavirus COVID-19, y su agente etiológico como coronavirus del síndrome respiratorio agudo severo 2 (SARS-CoV-2), ha mostrado una rápida propagación comunitaria, regional e internacional(1). De tal forma, con corte a 19 de mayo de 2020, se han confirmado a nivel global un total de 4'731.458 casos y 316.169 muertes(2); mientras que, en Colombia, desde el 6 de marzo hasta el 18 de mayo(3), se han presentado un total de 16.295 casos confirmados y 592 fallecidos.
En vista de que actualmente en varios países el virus SARS-CoV-2 muestra transmisión comunitaria en las Américas, la Organización Panamericana de la Salud (OPS) y la Organización Mundial de la Salud - OMS recomiendan a los países miembros “garantizar la identificación oportuna de casos sospechosos, la toma y el envío de muestras a los laboratorios de referencia, y la implementación de protocolos de detección molecular, según la capacidad del laboratorio”(4).
Bajo esta situación, el 12 de marzo de 2020 el Ministerio de Salud y Protección Social mediante Resolución número 385 de 2020 declaró la emergencia sanitaria en todo el territorio nacional, lo que ha derivado la adopción de lineamientos y documentos técnicos en desarrollo de la estrategia para controlar la pandemia por el Coronavirus COVID-19.
Ahora, en el marco de responsabilidades designadas a la Superintendencia Nacional de Salud bajo este contexto, se encuentra que, en los artículos 25 y 26 del Decreto número 2323 de 2006, por el cual se reglamenta parcialmente la Ley 9 de 1979 en relación con la Red Nacional de Laboratorios y se dictan otras disposiciones, se establecen las autoridades sanitarias de la Red Nacional de Laboratorios con competencia para ejercer las acciones de inspección, vigilancia y control, las cuales deben adoptar medidas de prevención y seguimiento que garanticen la protección de la salud pública y el cumplimiento de lo dispuesto en este decreto.
Con la Resolución 521 de 2020 del Ministerio de Salud y Protección Social, además de adoptarse “el procedimiento para la atención ambulatoria de población en aislamiento preventivo obligatorio con énfasis en población con 70 años o más o condiciones crónicas de base o inmunosupresión por enfermedad o tratamiento, durante la emergencia sanitaria por COVID-19”, y de establecerse las responsabilidades de cada uno de los actores del SGSSS que hacen parte de este procedimiento; en el artículo 3o se define que corresponde a la Superintendencia Nacional de Salud hacer cumplir lo dispuesto por esta resolución y advertir su inobservancia.
Los Decretos número 488 y 500 de 2020, en sus artículos 5o y 3o, respectivamente, establecen que para las ARL públicas y privadas deben adelantar: “(...) compra de elementos de protección personal y chequeos médicos frecuentes de carácter preventivo y diagnóstico, así como acciones de intervención relacionadas con la contención, mitigación y atención del nuevo Coronavirus COVID-19, enfocadas en personal directamente expuesto a contagio (...)”.
Mediante el artículo 13 del Decreto número 538 de 2020, por el cual se adoptan medidas en el sector salud, para contener y mitigar la pandemia de COVIO-19 y garantizar la prestación de los servicios de salud, en el marco del Estado de Emergencia Económica, Social y Ecológica, se establece la eliminación de requisitos para incluir dentro de la tabla de enfermedades laborales, el Coronavirus COVID-19 como enfermedad laboral directa, respecto de los trabajadores del sector salud, incluyendo al personal administrativo, de aseo, vigilancia y de apoyo que preste servicios en las diferentes actividades de prevención, diagnóstico y atención de esta enfermedad.
De igual manera, el Ministerio de Salud y Protección Social en los literales d) y k) del artículo 3o de la Resolución número 676 de 2020 dispone que corresponde a las secretarías de salud o las entidades que hagan sus veces, Red Nacional de Laboratorios, entidades promotoras de salud del Régimen Contributivo y Subsidiado, entidades pertenecientes al Régimen Especial y de Excepción en salud, entidades que administran planes adicionales de salud, prestadores de servicios de salud públicos, privados y mixtos, Instituto Nacional de Salud, así como otras entidades que generen, operen o provean información relevante para el seguimiento de la pandemia de COVID-19, realizar el reporte de: “casos diagnosticados por laboratorio para COVID-19, a partir de la base de datos de resultados generados por los laboratorios de la Red Nacional de Laboratorios (...)”, así como reportar la “Capacidad instalada de laboratorios disponibles y pruebas diagnósticas para COVID-19 y otros virus respiratorios registrados a través de RELAB (...)” en concordancia con la Resolución número 561 de 2019. En el artículo 6o de la misma resolución, se delega a la Superintendencia Nacional de Salud como entidad responsable de realizar la inspección, vigilancia y control correspondiente.
Adicionalmente, el Ministerio de Salud y Protección Social mediante la Circular 019 del 2020 precisa elementos centrales para la detección temprana SARSCoV-2/covid-19, a partir de la cual se definieron los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia versión 3”. Con base en esta Circular, el Instituto Nacional de Salud expidió la Circular 1000-019 del 8 de mayo de 2020 informando la actualización de lineamientos técnicos sobre manejo de muestras, las cuales se armonizan con las “Orientaciones para la vigilancia en salud pública de la COVID-19”, el “Anexo. Instructivo para la vigilancia en salud pública intensificada de infección respiratoria aguda asociada al nuevo corona virus 2019 (COVID-19)”, y los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia”.
Asimismo, en el artículo 3o de la Resolución número 731 de 2020, por la cual se establecieron los lineamientos para garantizar la atención en salud y el flujo de recursos a los diferentes actores del SGSSS durante la emergencia sanitaria por COVID-19, se precisa que “Durante la emergencia sanitaria ocasionada por el COVID-19, ninguna EPS puede omitir las funciones indelegables del aseguramiento en salud, esto es, la administración del riesgo financiero, la gestión del riesgo en salud, la articulación de los servicios que garantice el acceso efectivo y la prestación de los servicios de salud por cualquier patología o situación de salud, así como la representación del afiliado ante el prestador y los demás actores sin perjuicio de la autonomía del usuario (...)” (cursiva y negrilla fuera de texto); y en el artículo 5o de esta misma resolución, se designa la responsabilidad de la Superintendencia Nacional de Salud de ejercer la inspección, vigilancia y control a –entre otros componentes– la atención integral a los afiliados.
Es así que, ante la emergencia sanitaria por el nuevo Coronavirus, la Superintendencia Nacional de Salud adelanta acciones de vigilancia e inspección con enfoque de riesgo que aporten a la mitigación y supresión del virus en el país según los niveles de responsabilidad de los actores del SGSSS, incluyendo el monitoreo de la disponibilidad, oportunidad y capacidad para la toma y procesamiento de muestras para el diagnóstico de COVID-19 en cada departamento.
II. INSTRUCCIONES
PRIMERA: ENTIDADES PROMOTORAS DE SALUD, ENTIDADES ADAPTADAS Y REGÍMENES ESPECIAL y DE EXCEPCIÓN.
a) Garantizar que los laboratorios a cargo del procesamiento de las pruebas diagnósticas de COVID-19 de sus afiliados, se encuentren inscritos en la Red Nacional de Laboratorios - RELAB Y autorizados por el INS para tal fin.
b) Realizar capacitación permanente a los funcionarios, empleados y usuarios respecto al evento epidemiológico, en aspectos relacionados con detección, diagnóstico y manejo, acorde con la normatividad vigente. Es importante la actualización permanente de los funcionarios ante el comportamiento cambiante de la pandemia que obliga a realizar actualizaciones y modificaciones.
c) Verificar el cumplimiento en la realización de pruebas a las personas según la definición de casos vigente definidas en el documento de “Orientaciones para la vigilancia en salud pública de la COVID-19”, “Anexo. Instructivo para la vigilancia en salud pública intensificada de infección respiratoria aguda asociada al nuevo coronavirus 2019 (COVID-19)” y de acuerdo, con los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia” por parte de su red contratada.
d) Garantizar las pruebas para el diagnóstico de COVID-19, así como el procesamiento y resultados de acuerdo a lo establecido por la Resolución número 521 de 2020 en población mayor de 70 años o más o que tengan condiciones crónicas de base o inmunosupresión por enfermedad o tratamiento y gestantes, con calidad y oportunidad.
e) Monitorear en su red de prestadores de servicios de salud que el personal a cargo de la toma de muestras para diagnóstico de SARS-CoV-2 (COVID-19) cuenten con la capacitación adecuada o experticia para este proceso.
f) Verificar la realización de pruebas post mortem a todos los casos de muerte probable por COVID-19 por parte de su red de prestadores de servicios de salud de acuerdo con los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia”.
g) Garantizar la toma de muestras mínimas requeridas, según las metas de coberturas establecidas por el INS en la Programación de EAPB por departamentos para testeo de respuesta COVID-19, en la estrategia “Respuesta Integrada COVID-19” en cada período, asegurando la contención de casos.
h) Monitorear la realización de la Búsqueda Activa Institucional por parte de los prestadores que hacen parte de su red de servicios de salud de acuerdo con las “Orientaciones para la vigilancia en salud pública de la COVID-19” y “Anexo. Instructivo para la vigilancia en salud pública intensificada de infección respiratoria aguda asociada al nuevo coronavirus 2019 (COVID-19)” vigentes, garantizando el adecuado flujo de la información del prestador al asegurador.
SEGUNDA: DIRECCIONES DEPARTAMENTALES Y DISTRITALES DE SALUD
a) Monitorear el cumplimiento de las metas de pruebas diagnósticas de SARS-CoV-2 (COVID-19) para la toma de muestras mínima requerida por EAPB en su jurisdicción, según lo establecido por el INS en la Programación de EAPB por departamentos para testeo de respuesta COVID-19, en la estrategia “Respuesta Integrada COVID-19” en cada período.
b) Realizar el seguimiento a los grupos poblacionales priorizados y a los contactos de los casos en el marco de la búsqueda activa en su jurisdicción, según lo dispuesto en las “Orientaciones para la vigilancia en salud pública de la COVID-19”, “Anexo. Instructivo para la vigilancia en salud pública intensificada de infección respiratoria aguda asociada al nuevo coronavirus 2019 (COVID-19)” y los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia”, vigentes.
c) Realizar la toma de muestras necesarias para el diagnóstico de SARS-CoV-2 (COVID-19) en la población no asegurada y en los conglomerados según su competencia.
d) Verificar la realización de pruebas post mortem a todos los casos de muerte probable por COVID-19 por parte de los prestadores de servicios de salud en su jurisdicción, de acuerdo con los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia”.
e) Los laboratorios de salud pública de las entidades territoriales departamentales y distritales deben realizar la verificación y control de la información aportada por los Laboratorios que se encuentren autorizados por el INS y que ofrezcan la realización de pruebas diagnósticas para COVID-19.
TERCERA: ADMINISTRADORAS DE RIESGOS LABORALES
a) Garantizar la búsqueda activa de casos de COVID-19 y la realización de pruebas a los trabajadores de la salud, teniendo en cuenta el artículo 13 del Decreto número 538 de 2020, los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia” vigentes, y demás que se definan a este propósito.
b) Verificar que los prestadores de servicios de salud y las instituciones de protección social a su cargo, realicen la identificación, registro y reporte de casos de personal de salud o personal de protección social que presente exposición a un caso confirmado de COVID-19 como se encuentra establecido en los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia” y en la normatividad vigentes aplicable para las ARL.
c) Seguimiento y toma de muestras a los casos reportados de personal de salud o personal de protección social que presente exposición a un caso confirmado de COVID-19, de acuerdo con los “Lineamientos para el uso de pruebas diagnósticas de SARS-CoV-2 (COVID-19) en Colombia”.
CUARTA: Las pruebas rápidas serológicas deben contar con los criterios de verificación establecidos por las autoridades competentes, considerado como gold estandar para el diagnóstico de SARS-CoV-2 (COVID-19) las pruebas de biología molecular- RT-PCR.
De acuerdo con lo anterior, para el reporte de información de la presente circular las pruebas diagnósticas son las realizadas mediante técnica de RT-PCR.
QUINTA: REPORTE DE INFORMACIÓN
Para efectos de reportar la información señalada en la presente circular, las entidades deben cumplir con las siguientes especificaciones técnicas para el cargue y reporte de la información:
a) Nombre del archivo: NITDVPPANNOFFFFF.EXT, la sintaxis que compone el nombre del archivo debe estar unida, sin caracteres de separación, y en el orden mencionado.
NITDVPPANNOFFFFF.EXT
Donde
NIT: Número de identificación tributaria de la entidad que reporta
DV: Digito de verificación
PP: Período de corte de la información reportada
ANNO: Año de corte de la información reportada
FFFFF: Número de archivo
EXT: Extensión del archivo de texto (txt)
b) Delimitado por Pipeline (1)
c) Firmado digitalmente por Representante Legal
d) La información debe remitirse de manera completa
e) Los anexos técnicos descritos en la presente Circular Externa, deberán ser reportados por las entidades vigiladas en formato txt.
SEXTA: Adicional a la información solicitada en la instrucción QUINTA, las Direcciones
Departamentales y Distritales, EPS, Regimenes Especial y de Excepción, ARL, deberán contar con los soportes del cumplimiento de las instrucciones impartidas, los cuales podrán ser solicitados por la Superintendencia Nacional de Salud en el momento que este considere pertinente.
SÉPTIMA: Conforme con el artículo 130 de la Ley 1438 de 2011, modificado por la Ley 1949 de 2019, es menester advertir que el incumplimiento en la calidad, completitud, oportunidad y consistencia del requerimiento de la Superintendencia Nacional de Salud bajo los lineamientos de la presente Circular puede dar lugar a las sanciones que correspondan.
OCTAVO: La presente Circular Externa aplica en los términos y lineamientos establecidos conforme con la normatividad vigente y con las que la definan y complementen en el contexto de la Pandemia COVID-19.
III. ANEXOS TÉCNICOS
Las entidades deben reportar la información de los siguientes anexos técnicos, los cuales deben estar firmados digitalmente por el representante legal de la entidad.
Anexo Técnico Archivo tipo PT014 - Seguimiento a la detección de casos de COVID-19 en las EAPB
Archivo tipo PT014
Seguimiento a la detección de casos de COVID-19 en las EAPB
Tipo de entidad a la que aplica: Entidades Promotoras de Salud, Entidades Adaptadas y Regímenes Especiales y de Excepción.
Periodicidad: Quincenal
Fecha de corte: Los días 15 y 30 o 31 de cada mes según día de finalización del mes a reportar (el primer reporte debe realizarse con corte a 31 de mayo de 2020).
Fecha del reporte: Al día siguiente a la fecha de corte (el primer reporte debe realizarse a
más tardar el 1 de junio de 2020)

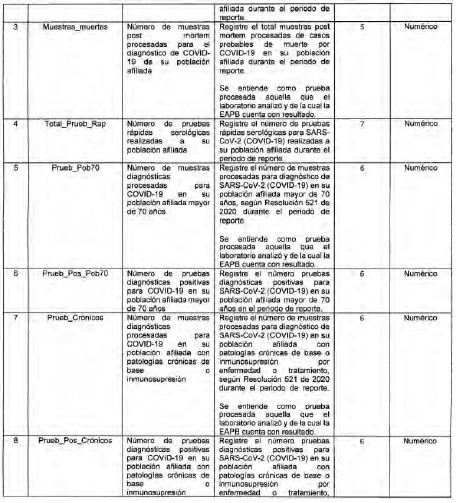
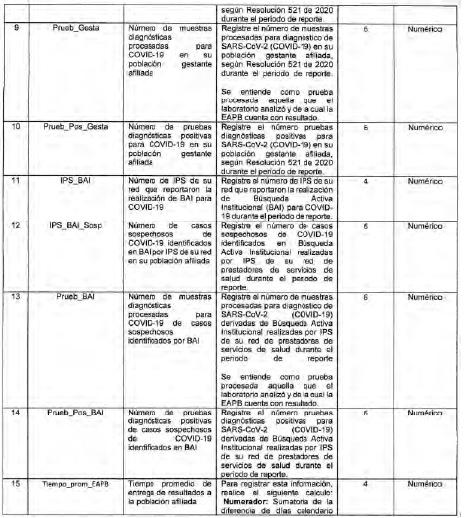

Anexo Técnico Archivo tipo PT015 - Reporte diario de pruebas diagnósticas para COVID-19 en la EAPB
Archivo tipo PT015
Reporte diario de pruebas diagnósticas para COVID-19 en la EAPB
Tipo de entidad a la que aplica: Entidades Promotoras de Salud, Entidades Adaptadas y Regimenes Especiales y de Excepción.
Periocicidad: Diaria
Fecha de corte: Dia (en el primer reporte debe incluir la información acumulada desdes el 14 al 24 de mayo de 2020)
Fecha de reporte: El dia siguiente a la fecha de corte (el primer reporte debe realizarse el 25 de mayo de 2020)
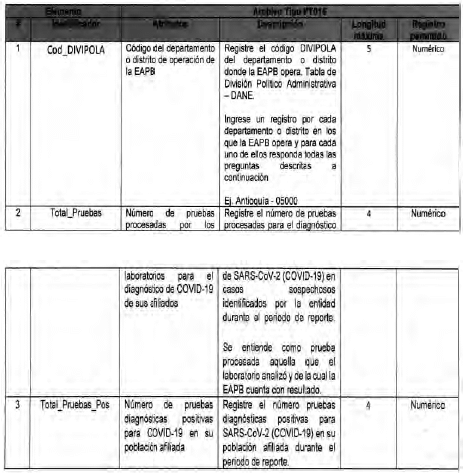
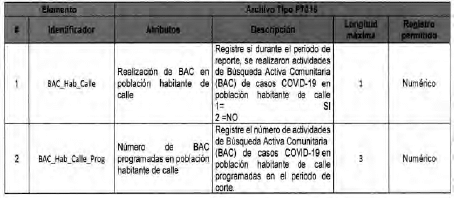
Anexo Técnico Archivo tipo PT016 - Seguimiento a la detección de casis de COVID-19 en las Entidades Territoriales
Archivo tipo PT016
Seguimiento a la detección de casos de COVID-19 en las Entidades Territoriales
Tipo de entidad a la que aplica: Entidades Territoriales Departamentales y Distritales
Periocicidad: Quincenal
Fecha de corte: Los dias 15 y 30 de cada mes según día de finalización del mes de reporte (el primer reporte debe realizarse con corte a 31 de mayo de 2020)
Fecha de reporte: El dia siguiente a la fecha de corte (el primer reporte debe realizarse a mas tardar el 1 de junio de 2020)
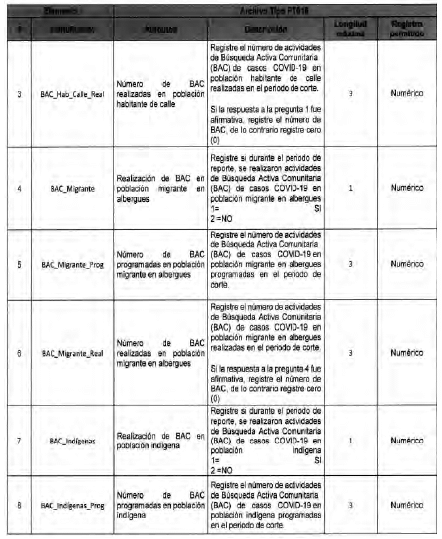
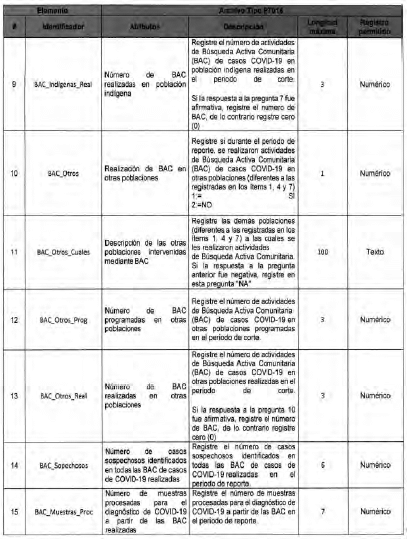
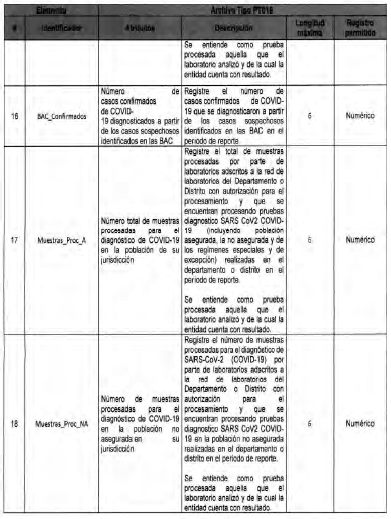
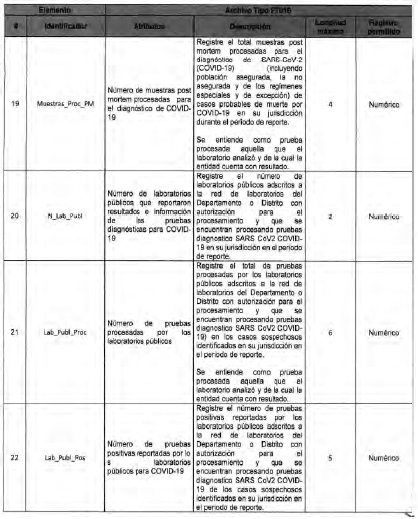
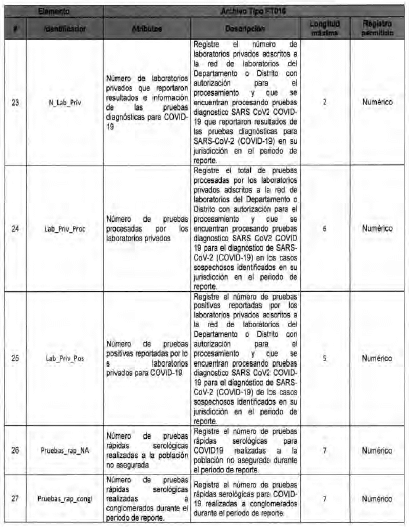
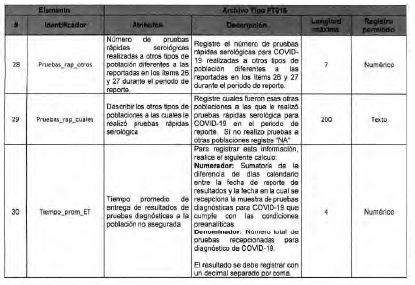
Anexo Técnico Archivo tipo PT017 - Reporte de pruebas diagnosticas por laboratotio
Archivo tipo PT017
Reporte de pruebas diagnosticas por laboratorio
Tipo de entidad a la que aplica: Entidades Territoriales Departamentales y Distritales
Periocicidad: Quincenal
Fecha de corte: Los dias 15 y 30 de cada mes según día de finalización del mes de reporte (el primer reporte debe realizarse con corte a 31 de mayo de 2020)
Fecha de reporte: El dia siguiente a la fecha de corte (el primer reporte debe realizarse a mas tardar el 1 de junio de 2020)
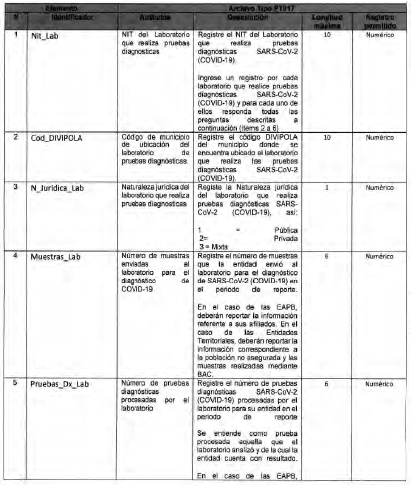
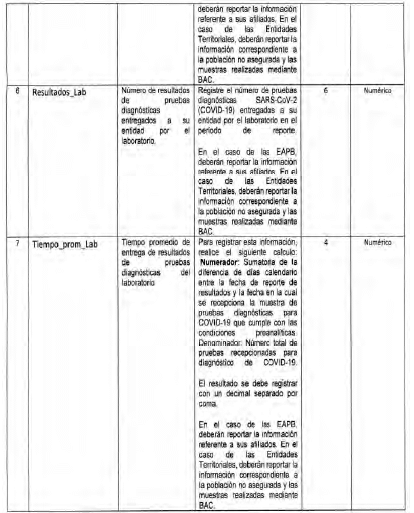
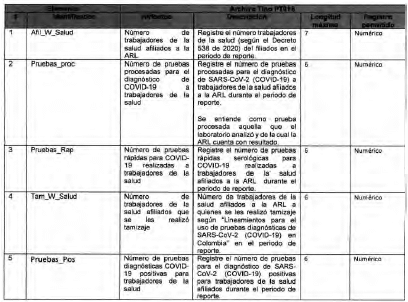
Anexo Técnico Archivo tipo PT018 - Seguimiento a la detección de casos de COVID-19 en trabajadores de la salud por parte de la ARL
Archivo tipo PT018
Seguimiento a la detección de casos de COVID-19 en trabajadores de la salud por parte de la ARL
Tipo de entidad a la que aplica: Administradoreas de Riesgos Laborales
Periocicidad: Quincenal
Fecha de corte: Los dias 15 y 30 o 31 de cada mes según día de finalización del mes de reporte (el primer reporte debe realizarse con corte a 31 de mayo de 2020)
Fecha de reporte: El dia siguiente a la fecha de corte (el primer reporte debe realizarse a mas tardar el 1 de junio de 2020)
IV. VIGENCIA
La presente Circular Externa rige a partir de la fecha de su publicación hasta que las autoridades competentes den por terminada la emergencia sanitaria por COVID-19.
Publíquese y cúmplase.
El Superintendente Nacional de Salud,
Fabio Aristizábal Ángel
"Instituto Colombiano para la Evaluación de la Educación - ICFES"
ISSN [2500-4409 En linea]
Última actualización: 29 de Noviembre de 2024 - (Diario Oficial No. 52.943 - 17 de Noviembre de 2024)
Las notas de vigencia, concordancias, notas del editor, forma de presentación y disposición de la compilación están protegidas por las normas sobre derecho de autor. En relación con estos valores jurídicos agregados, se encuentra prohibido por la normativa vigente su aprovechamiento en publicaciones similares y con fines comerciales, incluidas -pero no únicamente- la copia, adaptación, transformación, reproducción, utilización y divulgación masiva, así como todo otro uso prohibido expresamente por la normativa sobre derechos de autor, que sea contrario a la normativa sobre promoción de la competencia o que requiera autorización expresa y escrita de los autores y/o de los titulares de los derechos de autor. En caso de duda o solicitud de autorización puede comunicarse al teléfono 617-0729 en Bogotá, extensión 101. El ingreso a la página supone la aceptación sobre las normas de uso de la información aquí contenida.